Die anhaltende Pandemie der Coronavirus-Krankheit 2019 (COVID-19) hat sich negativ auf ältere Menschen ausgewirkt, wobei über 95 % der COVID-19-bedingten Todesfälle bei Personen über 60 Jahren auftraten.
Bewohner von Langzeitpflegeeinrichtungen (LTCF) haben jedoch ein höheres Sterblichkeitsrisiko erlitten als Personen derselben Altersgruppe, die in allgemeinen Gemeinschaften leben.
Es wird spekuliert, dass die höhere Sterblichkeitsrate in dieser Bevölkerung durch den Aufenthalt in Gemeinschaftseinrichtungen ausgelöst wird – was das Risiko der Übertragung von Infektionen erhöht.
Derzeit verfügbare COVID-19-Impfstoffe sind sowohl sicher als auch wirksam und helfen bei der Entwicklung der humoralen Immunität und des Zellschutzes. Es fehlen jedoch Daten zu älteren und geriatrischen Bevölkerungsgruppen. Mit zunehmendem Alter setzt sich die Immunseneszenz durch – gekennzeichnet durch eine fortschreitende Zunahme eines proinflammatorischen Zustands sowie eine verminderte Immunantwort auf Infektionen und Impfungen. Daher besteht ein unmittelbarer Bedarf, die Qualität und das Ausmaß der Immunreaktionen bei älteren Menschen zu bewerten, was bei der Entwicklung spezieller Impfkalender für das schwere akute respiratorische Syndrom Coronavirus 2 (SARS-CoV-2), die auf die Immunanforderungen der ältere Bevölkerungen.
Studie: Begrenzte Immunantworten nach drei Monaten BNT162b2-Impfstoff bei nicht mit SARS-CoV-2 infizierten älteren Menschen, die in Langzeitpflegeeinrichtungen leben. Bildquelle: Rido / Shutterstock
Die Studium
Um zu verstehen, wie humorale Anti-SARS-CoV-2-Antworten bei älteren Personen hervorgerufen werden, wurde eine prospektive Studie durchgeführt, um die humorale Anti-SARS-CoV-2-Antwort zu bewerten, die bei einer COVID-19-Impfung bei 82 Bewohnern von LTCF ausgelöst wurde sich von einer früheren SARS-CoV-2-Infektion erholt hatten und SARS-CoV-2-nicht infizierte Personen.
In dieser auf dem Preprint-Server medRxiv* veröffentlichten Studie wurde die humorale Reaktion auf SARS-CoV-2 vor und nach dreimonatiger Verabreichung der BNT162b2-mRNA-COVID-19-Impfung (Pfizer-BioNTech) untersucht. Darüber hinaus wurden die humoralen Reaktionen der Älteren mit denen einer jüngeren Gruppe verglichen und ein funktionelles Neutralisationsexperiment gegen das Wuhan-Hu-1 (WH1)-Virus und die Delta-Variante durchgeführt.
Diese prospektive Beobachtung [email protected] Studie rekrutierte 98 Teilnehmer über 65 von drei LTCF im nördlichen Bereich von Barcelona (Spanien). Plasmaproben wurden sechs Monate nach LTCF-Ausbrüchen (September-November 2020) und drei Monate nach Abschluss des Impfplans (April-Mai 2021) entnommen.
Um die Infektionsgeschichte aller Proben vor der Impfung zu beurteilen, wurde die SARS-CoV-2-Serologie untersucht. Vor der Impfung wurden ältere Menschen auf der Grundlage ihrer Polymerase-Kettenreaktion (PCR) und serologischen Ergebnisse in infizierte und nicht infizierte Gruppen eingeteilt. Anfang des Jahres 2021 wurden dann beide Studiengruppen mit dem BNT16b2-mRNA-Impfstoff (Pfizer-BioNTech) geimpft. Eine nachfolgende Probe wurde im Median 2,8 Monate nach der Impfung entnommen; ein zweiter serologischer Test gegen NP-Protein (NP) wurde bei den nicht infizierten Personen durchgeführt.
Die jüngere Teilnehmergruppe reichte von 22 bis 64 Jahren. Blutproben vor und nach der Impfung wurden zwischen den beiden Patientengruppen abgeglichen.
Ergebnisse
Bluthochdruck, Arthritis, Demenz und Diabetes waren die häufigsten chronischen Erkrankungen, die bei den älteren Teilnehmern diagnostiziert wurden. Während des LTCF-Ausbruchs wurden Personen mit Real-Time-PCR (RT-PCR) getestet. Es wurde festgestellt, dass 84 % der in die Studie eingeschlossenen Bewohner eine vorherige SARS-CoV-2-Infektion hatten – das Durchschnittsalter von 87 Jahren und 80 % Frauen. Bewohner, die vor der Impfung nicht infiziert waren, hatten ein Durchschnittsalter von 79 Jahren, und 50% waren Frauen. Nur ein nicht infizierter Bewohner hat sich nach der Impfung mit SARS-CoV-2 angesteckt – mit leichten Symptomen.
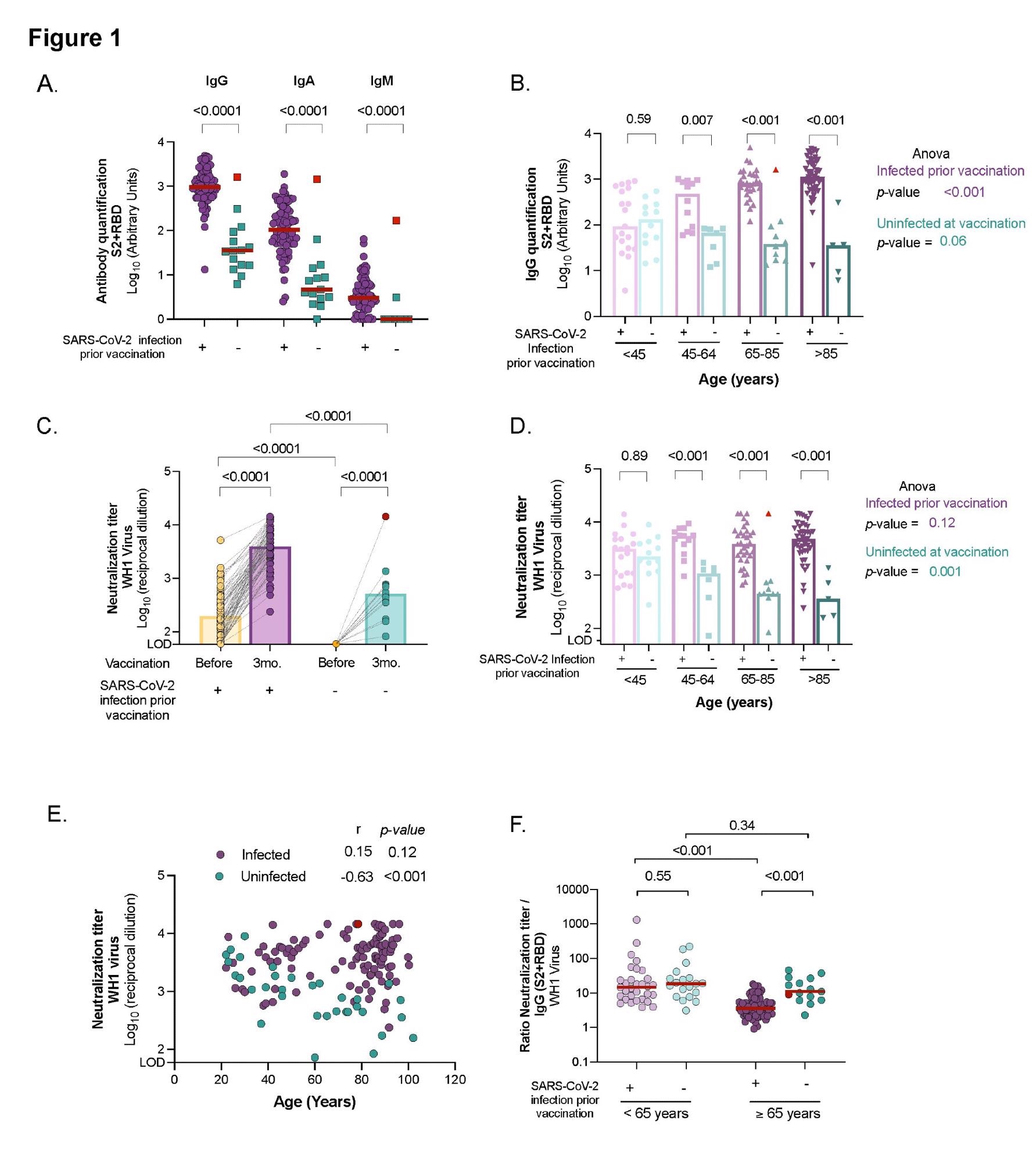
Vergleich der humoralen Reaktion und neutralisierenden Aktivität zwischen nicht infizierten und infizierten Personen unterschiedlichen Alters nach drei Monaten nach dem BNT162b2-mRNA-COVID-19-Impfstoff. Panel A: Spiegel von spezifischen SARS-CoV-2-Immunglobulinen (IgG, IgA und IgM) gegen S2+RBD-Proteine, quantifiziert im Plasma von nicht infizierten und infizierten älteren Menschen durch ELISA. Panel B: SARS-CoV-2-spezifische IgG-Antikörperspiegel (gegen S2+RBD-Proteine) nach altersübergreifender Impfung bei infizierten und nicht infizierten Teilnehmern. Panel C: Neutralisierende Aktivität gegen das WH1-Virus vor und nach dreimonatiger Impfstoffverabreichung bei infizierten und nicht infizierten älteren Menschen, die in LTCF leben. Panel D: Neutralisierende Aktivität gegen WH1 nach Impfung über alle Altersgruppen hinweg bei infizierten und nicht infizierten Teilnehmern. Panel E: Korrelation der neutralisierenden Aktivität nach der Impfung mit dem Alter bei infizierten und nicht infizierten Teilnehmern. Korrelationskoeffizient und p-Werte wurden aus der Spearman-Korrelation erhalten. Panel F: Verhältnis des Plasmaneutralisationstiters zu den gesamten SARS-CoV-2-IgG-Antikörpern bei jüngeren und älteren Personen, unterteilt nach früherer SARS-CoV-2-Infektionsgeschichte. Medianwerte sind angegeben; P-Werte wurden vom Mann-Whitney-Test zum Vergleich zwischen den Gruppen (Felder A, B, C, D und F), Wilcolxon für gepaarte Tests (Feld C) und Kruskal-Wallis-Test zum Vergleich zwischen den Altersbereichen für Infizierte und Nicht-Infizierte erhalten Gruppen (Panel B und D). In allen Panels sind nicht infizierte und infizierte Personen zum Zeitpunkt der Impfung in Türkis bzw. Violett angegeben. Nicht infizierte Bewohner, die sich nach Impfungen infiziert haben, sind rot markiert und wurden von der statistischen Auswertung ausgeschlossen.
Personen, die sich vor der Impfung mit SARS-CoV-2 infiziert hatten, hatten deutlich höhere Spiegel von SARS-CoV-2-spezifischen IgG-, IgA- und IgM-Antikörpern als diejenigen, die nicht infiziert waren. Darüber hinaus wiesen infizierte ältere Menschen einen signifikanten Anstieg aller Immunglobulin-Isotypen zwischen den Proben vor und nach der Impfung auf. Im Gegensatz dazu hatten nicht infizierte ältere Menschen drei Monate nach der Impfung messbare Spiegel spezifischer SARS-CoV-2-IgG- und IgA-Antikörper, aber kein IgM.
Insbesondere wiesen diejenigen, die sich nach der Impfung infizierten, ähnliche Spiegel spezifischer SARS-CoV-2-Antikörper auf wie die infizierten und geimpften Teilnehmer. Die älteren Teilnehmer hatten höhere IgG-Antikörperspiegel als die jüngeren Teilnehmer, die zuvor infiziert waren.
Bei den betroffenen Bewohnern wurden sechs Monate nach der Infektion (und vorheriger Impfung) höhere Spiegel von SARS-CoV-2 IgG-Antikörpern nachgewiesen als bei der jüngeren Bevölkerung. In der Zwischenzeit tendierten bei nicht infizierten geimpften Patienten die Spiegel der zirkulierenden spezifischen SARS-CoV-2-IgG-Antikörper unabhängig von ihrem Alter dazu, abzunehmen, und die Spiegel waren negativ mit dem Alter korreliert.
Bei allen älteren Menschen erhöhte die SARS-CoV-2-Impfung die Antikörpertiter, wobei die Neutralisationskapazität bei Teilnehmern mit einer Vorgeschichte einer SARS-CoV-2-Infektion erheblich höher war. Es gab einen medianen Anstieg der Antikörpertiter von 18,7 für die infizierte Population unter den Proben vor und nach der Impfung.
Nach der Immunisierung hatten die Bewohner, die sich mit der Infektion infiziert hatten, ähnliche Titer an neutralisierenden Antikörpern wie die infizierte Gruppe. Während Personen, die bereits infiziert waren, unabhängig von ihrem Alter und dem Schweregrad von COVID-19 identische Plasmaneutralisationskapazitäten aufwiesen. Im Vergleich zur jüngeren Gruppe riefen die infizierten älteren Menschen einen höheren Anstieg der humoralen Reaktionen nach der Immunisierung hervor. Auf der anderen Seite zeigten nicht infizierte geimpfte Untergruppen einen progressiven Abfall der neutralisierenden Titer im Laufe der Zeit.
Diese Ergebnisse deuten darauf hin, dass nicht infizierte ältere Erwachsene niedrigere neutralisierende Antikörpertiter haben und möglicherweise anfälliger für eine SARS-CoV-2-Infektion sind als zuvor infizierte Personen derselben Altersgruppe.
Darüber hinaus wurde berichtet, dass die mRNA-Impfung bei älteren Menschen wirksame neutralisierende Antikörper hervorruft, wenn auch in geringeren Mengen. Es wurde festgestellt, dass Delta-Formen von besorgniserregenden Varianten (VOC) eine viel geringere Plasmaneutralisationskapazität als WH1 bei allen älteren und jüngeren Personen erzeugen, unabhängig vom früheren Infektionsstatus des Wirts.
Bei geimpften, nicht infizierten Personen wurde ein progressiver Abfall der Neutralisationsgrade über alle Altersstufen gegen die Delta-Variante ähnlich denen gegen das ursprüngliche Virus (WH1) festgestellt. Bei nicht infizierten geimpften Personen über 65 Jahren war jedoch eine Neutralisationskapazität gegen die Delta-Variante kaum nachweisbar. Bemerkenswert ist, dass bei Menschen, die zuvor mit SARS-CoV-2 infiziert waren, ihre Neutralisationsfähigkeiten gegen die Delta-Variante mit dem Alter dramatisch zugenommen haben. Im Vergleich zu allen anderen Gruppen riefen ältere Menschen eine stärkere Kreuzneutralisation der Delta-Variante hervor.
Die Ergebnisse zeigten, dass nur nicht infizierte Personen, die keine ausreichende Immunantwort entwickeln, von einer Auffrischimpfung profitieren würden. Ein maßgeschneiderter Impfkalender ist erforderlich, um den Immunitätsbedarf dieser gefährdeten Bevölkerungsgruppe zu decken. Bezeichnenderweise scheint die Hybridimmunität bei älteren Menschen aktiv zu sein und kann bei der Gestaltung von Impfkampagnen hilfreich sein.
*Wichtiger Hinweis
medRxiv veröffentlicht vorläufige wissenschaftliche Berichte, die keinem Peer-Review unterzogen werden und daher nicht als schlüssig betrachtet werden, die klinische Praxis/das gesundheitsbezogene Verhalten leiten oder als etablierte Informationen behandelt werden sollten.